无标记类器官成像数据的自动分析
建立测量类器官药物反应的有效无标记图像批处理分析工作流程
简介
诸如微球和类器官等3D体外模型为研究人员提供了比传统2D细胞培养模型更具生理相关性的微环境。然而,创建用于测量类器官反应的有效工作流程可能颇具挑战性。
在本研究中,我们利用cellSens软件的宏功能为无标记类器官数据制作批处理图像分析工作流程。之后我们将结果与CellTiter-Glo 3D细胞活力分析进行比较,以评估分析速度并确定对象检测和测量的准确性和灵敏性。
应用工作流程
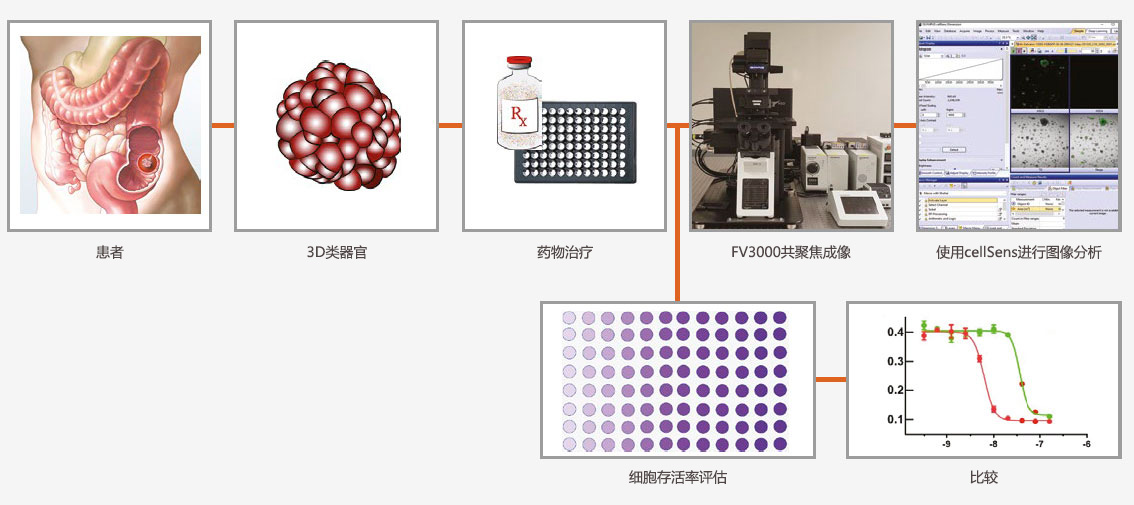
优势
- 无标记类器官成像
- 自动化图像处理、分割、测量和数据导出
- 可加快药物筛选过程的批处理分析
方法
器官培养
在Costar 96孔板中培养取自结肠癌患者的类器官。对其中一些孔使用星形孢菌素(ST)进行处理,以比较类器官对处理的反应。
成像
在奥林巴斯FV3000共聚焦激光扫描显微镜的透射光检测器中对类器官进行成像。使用远红外激光(640 nm)和4倍物镜生成透射光通道图像。由于类器官位于不同的Z位置,因此使用Z-stack采集图像。步进长度为5 μm。
利用cellSens宏功能进行图像分析
使用cellSens宏功能执行图像分析仅需两步:记录宏以及运行批处理分析。
1. 记录宏
在宏管理器中,可以将多个步骤记录为一组命令。在本分析中,我们记录了以下命令:
- 选择通道:选择用以分析明场图像的透射光通道。
- Sobel:使用Sobel滤波器作为“边缘检测滤波器”。
- EFI处理:使用实时扩展对焦图像(EFI)进行2D投影。
- 分割:使用自动阈值分割类器官。使用填充孔功能填充所检测到的类器官空白区域。
- 中位数:使用中位数滤波器平滑物体面具边缘并消除较小噪声。
- 计数和测量:对类器官的数量和形态特征进行了测量。可使用尺寸滤波器选择某些类器官细胞群。
- 导出到工作簿:将测量值导出到电子表格。

图1:作为宏过程记录的cellSens图像分析步骤
2. 运行批处理分析
利用宏功能中的批处理运行模式,我们可以对指定文件夹内的多个图像运行所记录的宏。分析结果自动导出为电子表格。

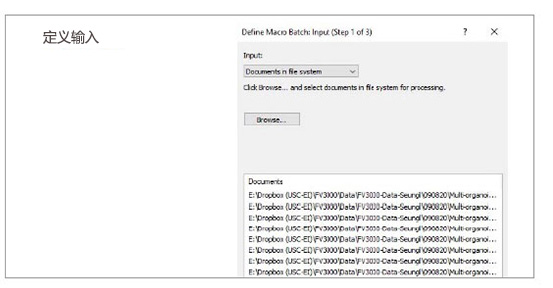
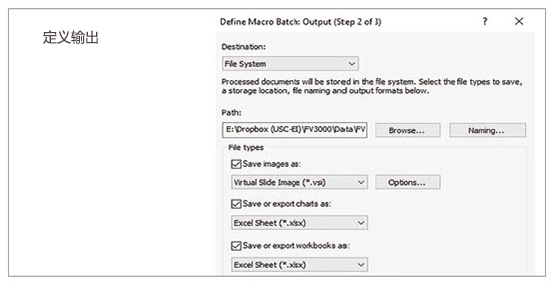
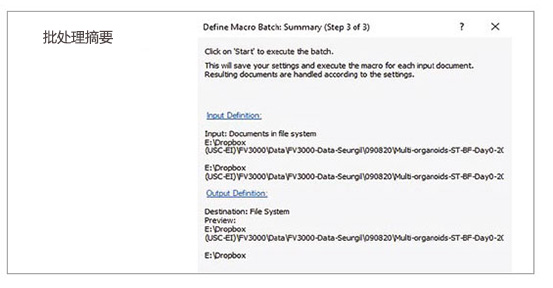
图2:利用所记录宏过程进行批处理分析的步骤
CellTiter-Glo 3D活力测定
为每个测量日准备单独的96孔类器官板。将CellTiter-Glo 3D试剂添加到每个孔内,并使用多孔板读板机测量细胞活力信号(ATP水平)。
结果
类器官尺寸
在未经处理的类器官培养物中,类器官尺寸相关参数(面积、周长和半径)随时间增加。0.1μMST处理诱导细胞和类器官死亡。类器官的生长受到完全抑制,经ST处理的类器官中类器官的尺寸没有明显增加。
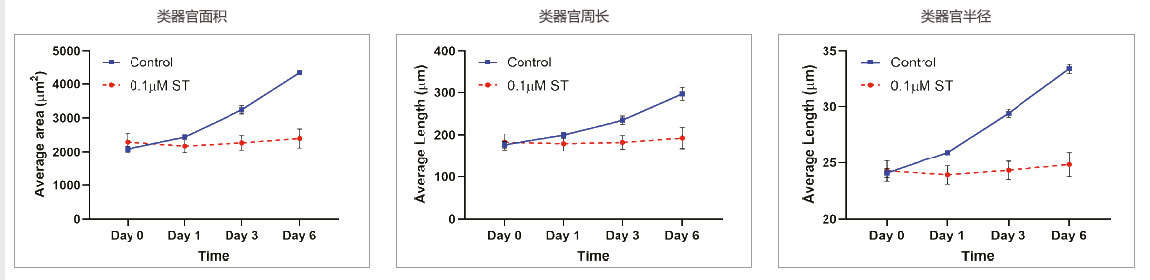
图3:对照:n = 3700.1μMST:n = 234。未经处理和经0.1μM ST处理的类器官,其尺寸相关参数随时间的变化。
类器官形态
测量了类器官态形态相关参数(形状因子和球形度)。在经ST处理的类器官中,形状因子值较高,表明这些类器官具有更圆的形状。未经处理类器官的形状因子值较低,表明这些类器官具有更不对称且分支的形状。未经处理和经ST处理的类器官的球形度值没有显著变化。
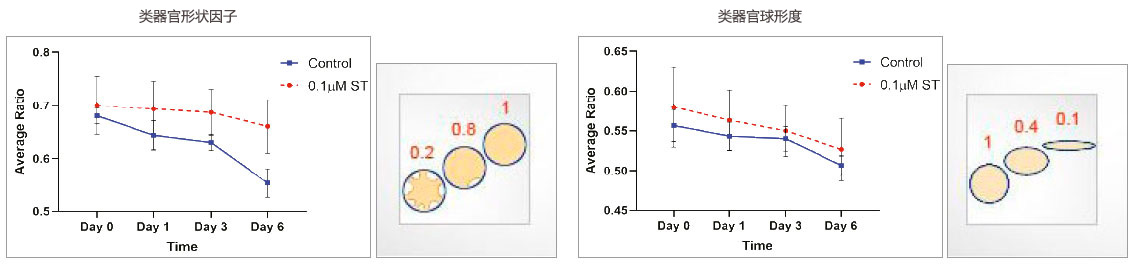
图4:类器官形态相关参数随时间变化的测量值
与细胞活力测定的比较
利用CellTiter-Glo 3D和成像方法均可测量类器官的生长。使用cellSens分析(面积)可以更早地显示类器官生长的差异。由于成像方法随时间变化始终使用同一孔板,因此在cellSens量化分析中每个数据点的变化均较小。细胞活力测量是一种终点测定,其在各时间点使用不同的孔板,因此增加了变异性。

图5:细胞活力测定与基于成像cellSens分析的比较
结论
借助cellSens软件的宏功能,我们可以使用无标记数据建立快速成像和2D批处理图像分析过程。cellSens软件对象检测和测量的准确性和灵敏度高于CellTiter-Glo 3D细胞活力测定。此外,与从CellTiter-Glo读取单个参数的方式相比,cellSens还可利用图像数据执行多参数分析。另外我们还确认了,进行该分析无需熟悉宏编程语言,只需点击鼠标即可轻松完成。
作者
Seungil Kim, Brandon Choi,南加州大学洛杉矶分校劳伦斯·J·埃里森转化医学研究所,
Shohei Imamura,奥林巴斯美国公司
适于这类应用的产品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
对不起,此内容在您的国家不适用。