使用培养监控系统自动化迁移测定成像和量化
实验大纲
细胞迁移的信息在创伤愈合和癌症等众多研究领域都很有价值。在创伤愈合领域,可用于评估促进细胞迁移以闭合伤口的药物。在癌症领域,可用于评估抑制癌细胞转移和浸润的药物。进行这种测量的一种方法是迁移测定。在测定过程中,会对组织培养皿上的贴壁细胞向无细胞间隙中的迁移过程进行观察。执行迁移测定最重要和最具挑战性的环节是确定适当的迁移持续时间。过早分析的迁移测定无法显示不同条件之间的差异,而分析过晚的迁移测定会导致在测试和对照条件下的开放区域都完全充满细胞。以前,研究人员需要在正确的时间点手动对迁移测定进行成像,以获得量化所需的数据,然后手动应用他们的量化方法。
在本文中,我们报告了抗癌药物索拉非尼对MCF7人乳腺癌细胞系的细胞迁移抑制作用的分析。我们还展示了如何使用奥林巴斯Provi CM20培养监控系统实现迁移测定的成像和定量的自动化。
试验流程
MCF7细胞在补充有10%胎牛血清(FBS)和1%青霉素-链霉素的RPMI-1640培养基中进行了培养。使用Ibidi 2孔细胞培养池(ibidi,目录编号ib80209)以105,000个细胞/70 μL/室的密度在24孔板上接种了细胞。Ibidi 2孔细胞培养池在接种24小时后移除,为细胞迁移创造间隙。将细胞洗涤了3次并用索拉非尼(10或30 μM)进行了处理或留作未处理的对照组。CM20监控器每隔一小时自动对细胞进行一次成像,最长持续94小时,以量化融合度来评估细胞迁移。
结果
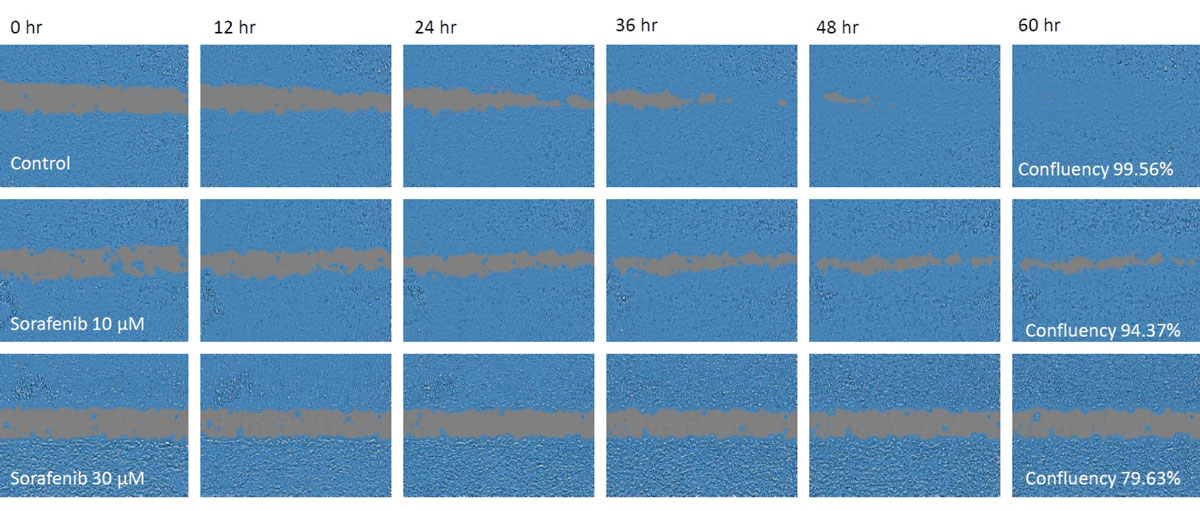
图1.迁移测定期间的细胞图像。
上:对照组,中:10 μM索拉非尼,下:30 μM索拉非尼。遮蔽区域表示CM20监视器自动探测到的融合区域。
两个经索拉非尼处理组的细胞迁移均减少,且减少幅度与索拉非尼浓度成正比,并且在48小时时仍保持开放状态,而对照组在该时间点已关闭。

图2.迁移测定期间融合度的量化。
上:对照组,中:10 μM索拉非尼,下:30 μM索拉非尼。
使用CM20监视器对融合度的定量显示与细胞观察的结果一致。对照组细胞在48小时的时候显示出接近100%的融合度,而经索拉非尼处理的细胞显示出与索拉非尼浓度成比例的融合度下降。

图3.48小时后与对照组的关闭定量比较。
Bar = 平均值± SE,n=3
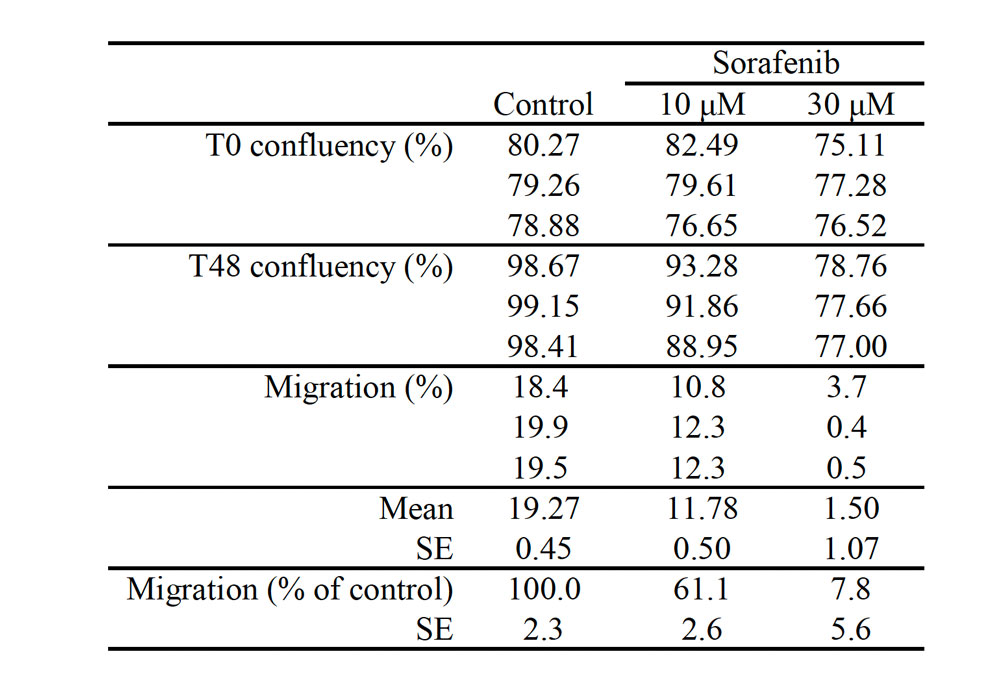
表1.迁移测定期间细胞迁移的量化。
通过从48小时处理后的融合度水平中减去处理开始时的融合度水平确定了细胞迁移。结果发现细胞迁移按照索拉非尼浓度成比例地受到显著抑制。
使用培养监控系统进行评估的好处
我们可以在迁移测定中使用CM20培养监控系统有效地探测抗癌药物的细胞迁移抑制作用。
在迁移测定中,设置适当的测量时间至关重要。在最快速条件(即本分析中的对照组)下完全迁移时进行评估,可以最准确地探测药物的效果。以前,需要每隔几个小时观察一次细胞以检查迁移情况,因此需要根据研究人员的时间表进行实验规划。即便如此,仍存在一夜之间完全迁移的风险。CM20监视器通过随着时间的推移自动成像和量化细胞迁移来解决这个问题。该系统使用户能够方便地随时对细胞进行分析,从而大大提高了工作流程的效率。使用培养监控系统进行迁移实验有可能节省研究人员的时间、提高准确性和一致性,并带来更成功的测定。
致谢
本应用说明由以下研究人员协助编写:
ACEL, Inc. 首席研究员 Takahiro Yamaguchi 博士
适于这类应用的产品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
对不起,此内容在您的国家不适用。