IXplore SpinSR助力科技前沿:揭示运动性多纤毛精细结构正确组装的调控机制
1. “摆动”的纤毛
纤毛的直径0.2微米左右(1微米=10-6米),只相当于头发丝的几百分之一。纤毛的长度不一,短的仅几微米,长的有数十微米及以上(通常称作鞭毛)。纤毛就像造物主为细胞精心设计的“桨”。对草履虫而言,纤毛就像微型船桨,没有它们,草履虫就无法在水中游动。
但体型较大的动物不需要靠纤毛移动身体,随着生物进化,这些“船桨”承担起更多更复杂的功能。它们不仅能够提供运动的动力来源,例如推动精子和卵子结合;有些还被改装成“天线”,去感受外界的刺激。
大多数动物细胞表面,包括人体几乎所有类型细胞表面都有纤毛。纤毛分为动纤毛和静纤毛,而动纤毛多数是成簇存在。多纤毛细胞是一类终末分化的上皮细胞,表面长有多至数百根的运动纤毛,在高等动物体内主要分布于气管、脑室管膜及输卵管等上皮组织,其纤毛的周期性摆动可以湿润、清洁气管,驱动脑脊液流动和受精卵运动。正因为如此,纤毛这一分布广泛、结构精巧的细胞器已经引起科学家越来越广泛的重视。当“船桨”和“天线”出现故障时,将对人类的健康产生多种影响。人类纤毛异常导致的疾病统称纤毛病。很多人对这个名称不熟悉,因为纤毛病的病征非常广泛,涉及医院多数科室,并缺乏常规的临床诊断方法,因此医患双方更习惯于称呼具体的症状,其实纤毛病是常见的遗传病。
纤毛的重要性在于它们能够“摆动”,从而为细胞在水中的运动提供推力。那么,究竟纤毛为何能动呢? 在放大倍数极高的电子显微镜的帮助下,人们发现纤毛呈现精美的结构:圆柱形的细胞膜包围着9对呈环形分布的二联体微管(微管是一种属于“细胞骨架”的由微管蛋白组成的管状结构)和两根中央微管;每对二联体微管都向纤毛中心伸出一排轮辐状的结构与中央微管周围的一个鞘状结构相连,并向隔壁的二联管伸出一排“外动力臂”和一排“内动力臂”。
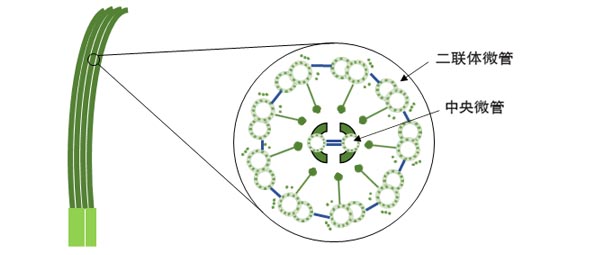
图1、纤毛的结构示意图
2. “一仆二主”的中心粒
纤毛不是空中楼阁,它的形成需要一个“地基”。这个地基叫“基体”,是一个特化的中心粒。中心粒通常在细胞里成对出现,每对中心粒周围可以聚集一些特定的蛋白质,形成叫作“中心体”的结构,在细胞里负责生长和锚定微管,因此中心体也叫“微管组织中心”。细胞在分裂前复制其遗传物质染色体的过程中,两个中心粒会在其侧面各“生”出一个子中心粒,从而使中心体也变成两个。随后,这两个由母-子中心粒组成的中心体及其周围的放射状微管,会形成一个纺锤状结构——纺锤体。纺锤体以中心体为两极,负责将遗传物质(染色体)均等地分配到两个子细胞中。分裂完成后,每个子细胞不仅获得相同数目的染色体,还各分得一个中心体。
当细胞处在不增殖的所谓静息期时,母中心粒就会被锚定到细胞膜上,并在其顶端长出纤毛。当该细胞要发生增殖时,伴随子中心粒的产生,纤毛会逐渐缩短,并在细胞分裂前完全消失,使中心体可以被释放到细胞质中去参与纺锤体的形成。可见,中心粒“一仆二主”,要在中心体和纤毛中承担两个不同的角色。
3. “凭空出现”的多中心粒
中心粒发生既然实行的是“一胎”政策,多纤毛细胞(如草履虫等纤毛虫)中大量的中心粒从何而来?早在20世纪60年代,细胞生物学家利用电子显微镜就观察到,多纤毛细胞形成的过程中中心粒会出现快速扩增。这时,母中心粒打破了“一胎制”,能够在其周围“生”出多个子中心粒。他们还意外地发现,更多的中心粒其实是在很多被称作“摇篮体”的圆形结构周围形成的。
然而几十年过去了,人们对中心粒“凭空”出现的原因几乎一无所知,直到2013年我们实验室的一项研究才揭开了这个谜团 [Zhao et al., Nat Cell Biol, 2013, 15(12):1434-44]。我们发现,在高等动物中一对同源蛋白质Deup1和Cep63分别调控了多纤毛发生过程中“从无到有”和“母中心粒依赖”的两种中心粒扩增方式,阐明了多纤毛细胞中大量中心粒的起源问题。
4. 动纤毛的精确组装机制
但是,运动纤毛含有数百种蛋白质组分,在多纤毛细胞分化过程中被大量合成。它们是靠纯粹的自发组装还是有特定的方式归类贮存、按需使用,是另一个重要且悬而未决的科学问题。
我们最新发表的研究成果揭示了多纤毛细胞特有的亚细胞结构-纤维状颗粒物(fibrogranular materials, FGMs)作为组织者对动纤毛的精确组装起重要调控作用[Zhao & Chen et al., Nat Commun, 2021, 12(1):1273]。
纤维状颗粒物是一种仅出现于高等动物多纤毛细胞的亚细胞结构,尽管在上世纪60年代的电镜研究中已被发现,但除了知道其中含有中心体周围基质蛋白Pcm1外,其组成与功能至今还不清楚。结合蛋白组学、超高分辨率显微成像、活细胞高速显微成像和多种电镜技术,我们发现:
- 纤维状颗粒物是由Pcm1相分离形成的具有液体特征的大型(直径可达2微米)、动态的无膜细胞器,它们不仅黏附摇篮体,而且在其桑果状的结构中大量富集了特定的基体和纤毛的结构蛋白质,这些组分在纤毛发生的不同阶段定位到基体和纤毛中。
- 人为敲低Pcm1的蛋白水平,不仅使多纤毛细胞无法形成纤维状颗粒物,而且导致摇篮体数目、大小和分布异常。有趣的是,尽管这些细胞最终形成的纤毛数目与对照细胞无异,其纤毛和基体的超微结构却出现明显缺陷,导致纤毛摆动方式和能力严重异常。
- 深入的分析发现在纤维状颗粒物中富集的组分提前定位到了基体,而且纤毛中央微管基部的结构显著延长,说明它们组装的时间顺序性被打破,从而影响运动纤毛结构的精确性和功能。
因此,纤维状颗粒物在多纤毛细胞分化过程中行使组织者的功能,既作为纤毛相关组分的贮藏室,又黏附摇篮体、富集于新生纤毛基部附近,保证运动纤毛精细结构组装的有序性和正确性。
![图2、(A)聚焦离子束扫描电镜(FIB-SEM)展示多纤毛细胞中纤维状颗粒物与摇篮体的空间分布;(B)纤维状颗粒物结构可以富集基体的结构蛋白质Cep120;(C)敲低Pcm1的蛋白水平导致动纤毛超微结构出现明显缺陷;(D)Pcm1片段具有相分离的特性[Zhao & Chen et al., Nat Commun, 2021, 12(1):1273]。](https://lifescience.evidentscientific.com.cn/data/Image/Application/revealing-the-regulatory-mechanisms/appnote_revealing-the-regulatory-mechanisms_02.jpg?rev=4BA8)
图2、(A)聚焦离子束扫描电镜(FIB-SEM)展示多纤毛细胞中纤维状颗粒物与摇篮体的空间分布;(B)纤维状颗粒物结构可以富集基体的结构蛋白质Cep120;(C)敲低Pcm1的蛋白水平导致动纤毛超微结构出现明显缺陷;(D)Pcm1片段具有相分离的特性[Zhao & Chen et al., Nat Commun, 2021, 12(1):1273]。
5. IXplore SpinSR在解析多纤毛精细结构正确组装机制中的应用
在本篇研究论文中[Zhao & Chen et al., Nat Commun, 2021, 12(1):1273],我们借助了超高分辨率显微成像、活细胞高速显微成像以及电镜等多种成像技术,其中就包括Olympus IXplore SpinSR转盘共聚焦超分辨率显微镜活体实时成像技术,下面将具体介绍Olympus IXplore SpinSR在我们的研究中的实际应用情况。
双通道活细胞成像:分别在day-2和day-1用腺病毒和慢病毒感染小鼠脑室管膜上皮细胞(mEPCs),使其表达GFP-Pcm1和Deup1启动子下表达SNAP-Deup1。在day 3进行活细胞成像前,用加有200 nM SNAP-Cell TMR-Star的 mEPCs饥饿培养液于37℃培养箱中孵育30 min后用饥饿培养液洗净。用IXplore SpinSR转盘共聚焦超分辨率显微镜进行拍摄。激光功率488 nm、561 nm分别设定为15%、10%。曝光时间均为100 ms。以5 min的间隔记录图像65 min。拍摄时Z轴层间距为0.5μm,深度为8.5μm。
我们利用IXplore SpinSR转盘共聚焦超分辨率显微镜活体实时成像观察mEPC中GFP-Pcm1的动态行为。具体实验流程如下:在day -2的野生型mEPC前体细胞中感染腺病毒以表达GFP-Pcm1,在day -1感染慢病毒以表达Deup1启动子控制的SNAP-Deup1,然后在day 3使用转盘共聚焦显微镜成像。由于SNAP-Deup1的表达受Deup1启动子控制,因此SNAP-Deup1阳性小点的出现,表明该细胞正经历中心粒扩增。活体成像结果显示:(1)在mEPC中SNAP-Deup1标记的摇篮体与GFP-Pcm1标记的FGMs存在明显的共定位。二者大小不同,但共同移动(n = 10);(2)尺寸较大的FGMs点似乎完全包裹了摇篮体,有时几个摇篮体被局限在一个大的FGMs点中;(3)当两个FGMs点相遇时,会逐渐融合成一个较大的FGMs点,此时其内部摇篮体也融合在一起(图3)。因此,体内实验证明FGMs具有液体的特性且与摇篮体紧密结合。
![图3、活的mEPC中FGMs具有液体的特性并与摇篮体紧密结合。FGMs点具有液体特性并结合摇篮体。Day 3时每隔5 min实时成像活的mEPC。GFP-Pcm1和SNAP-Deup1分别指示FGMs和摇篮体。箭头指示图像序列两个FGMs焦点的融合事件 [Zhao & Chen et al., Nat Commun, 2021, 12(1):1273]。](https://lifescience.evidentscientific.com.cn/data/Image/Application/revealing-the-regulatory-mechanisms/appnote_revealing-the-regulatory-mechanisms_03.jpg?rev=3CAF)
图3、活的mEPC中FGMs具有液体的特性并与摇篮体紧密结合。FGMs点具有液体特性并结合摇篮体。Day 3时每隔5 min实时成像活的mEPC。GFP-Pcm1和SNAP-Deup1分别指示FGMs和摇篮体。箭头指示图像序列两个FGMs焦点的融合事件 [Zhao & Chen et al., Nat Commun, 2021, 12(1):1273]。
另外,由于mTECs生长在不透明的聚酯膜上,明场显微镜无法成像其多纤毛运动。我们将在Transwells中生长的mTECs与200 nM SiR-tubulin(Spirochrome,YS-SC002)孵育1 h,以荧光标记其多纤毛。用手术刀将聚酯膜切成膜边缘。将膜倒置在玻璃底的活体皿中进行成像。借助高速活体显微成像技术(Olympus SpinSR10)捕捉GFP-Centrin1阳性的mTECs运动纤毛的运动轨迹,我们发现在对照细胞中运动纤毛主要呈现规律性的麦浪式摆动,而在Pcm1敲低的mTECs中运动纤毛则是无规律的转动或彻底丧失运动能力(图4)。
为了定位被腺病毒感染的细胞,GFP-Centrin1的自发荧光首先被捕获在基体的平面上。然后将焦面移至多纤毛,在那里以15毫秒的间隔捕获SiR-tubulin的单层自发荧光3 s。将SiR-tubulin通道(640 nm)的激光功率设置为50%,以实现14毫秒的曝光时间。使用ImageJ做出纤毛运动的kymograph。
Related Videos

图4、Pcm1缺失导致mTECs纤毛运动异常 [Zhao & Chen et al., Nat Commun, 2021,12(1):1273]。
SpinSR解决方案
IXplore SpinSR 显微镜系统,专为快速三维超分辨成像和活细胞长时间观察设计,无需特殊标记手段即可实现低至110nm的XY分辨率。
- 活细胞成像
- 更深层的三维成像
- 无需特殊染料标记,即可获得多色超分辨成像
致谢本应用说明由以下研究人员协助编写:中国科学院上海生化学細胞生物学研究所鄢秀敏女士。 |
参考文献
1.Fibrogranular materials function as organizers to ensure the fidelity of multiciliary assembly
NATURE COMMUNICATIONS | (2021) 12:1273 | https://doi.org/10.1038/s41467-021-21506-8 | www.nature.com/naturecommunications
Huijie Zhao 1,2,7, Qingxia Chen1,3,7, Fan Li1,2, Lihong Cui4, Lele Xie1, Qiongping Huang1, Xin Liang 4,Jun Zhou 5, Xiumin Yan1 & Xueliang Zhu
适于这类应用的产品
Maximum Compare Limit of 5 Items
Please adjust your selection to be no more than 5 items to compare at once
对不起,此内容在您的国家不适用。
