荧光激发和发射的基本原理
荧光激发和发射的基本原理
荧光染料是光敏化合物,能够吸收特定波长的光能,并转化为波长更长的光。因此,荧光染料是细胞和组织研究中常用的检测试剂。荧光染料特有的电子构型让其具有独特的特征性吸收光谱(常与激发类似)和发射光谱。这些吸收和发射光谱显示了荧光的相对强度,通常纵坐标为相对强度,横坐标为波长。对于已知的荧光染料,制造商会告知光源激发强度峰值的波长,以及荧光发射强度峰值的波长。对于这些荧光染料的激发和发射光谱图与曲线来说,了解其来源很重要。
如何确定荧光染料的发射光谱
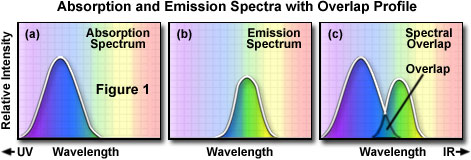
确定特定荧光染料的发射光谱时,需要确定最大吸收波长(常等同于最大激发波长)并在该波长下激发该荧光染料。图1(a)中显示了一个典型荧光染料的吸收光谱,纵坐标为吸收的相对强度,横坐标为波长。然后,我们用一个单色器(一种仅允许窄光波段通过的装置)进行扫描,得到全范围发射波长下相对应的荧光发射强度值。图1(b)中显示了基于各波长下荧光相对强度的测量值绘制的发射光谱。确定特定荧光染料的激发光谱时,也采用了类似的方法,即在用一组连续的波长激发荧光基团的同时,监测不同波长下的最大荧光发射强度。确定最大荧光发射强度,并只允许最大荧光发射强度对应波长的发射光通过检测器。在各激发波长下(通常通过单色器)诱导激发,并测量作为波长函数的发射荧光强度。测量结果可绘制为如图1(a)所示的图形或曲线,描绘了全范围激发波长光谱相对应的荧光强度。
激发和发射光谱的观察结果
一组典型的激发和发射曲线或光谱可让我们得到多个观察结果。激发光谱的长波长端和发射光谱的短波长端之间通常会有一个重叠区域。在荧光显微镜中,激发和发射强度与波长的重叠区域(如图1(c)所示)必须通过选择适当的激发滤光片、分光镜(反射光荧光)和发射滤光片来消除。否则,激发光太亮会掩盖较弱的荧光发射光,从而显著降低标本的对比度。
斯托克斯定律
当电子从激发态进入基态时,会有振动能损失(这一现象的解释见“荧光的分子机理”)。因为波长与辐射能成反比(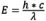 ),能量损失使发射光谱较相应的激发光谱更长。这种现象被称为斯托克斯定律(Stokes’ Law)或斯托克斯位移,由George G. Stokes爵士在十九世纪中期发现。斯托克斯位移越大,就越容易分离激发光和发射光。为了获得最高的荧光强度,最好在荧光染料激发波长的峰值处进行激发,在发射波长的峰值处(或由观察者选择的其他波长下)进行检测。激发波长和发射波长的选择由合适的滤光片控制,从而可限制允许通过的波长。在确定整个光学系统的光谱效果时,要求进行额外的技术校正,需要考虑诸如玻璃的透射率和检测器的灵敏度对应不同波长的差异等因素。
),能量损失使发射光谱较相应的激发光谱更长。这种现象被称为斯托克斯定律(Stokes’ Law)或斯托克斯位移,由George G. Stokes爵士在十九世纪中期发现。斯托克斯位移越大,就越容易分离激发光和发射光。为了获得最高的荧光强度,最好在荧光染料激发波长的峰值处进行激发,在发射波长的峰值处(或由观察者选择的其他波长下)进行检测。激发波长和发射波长的选择由合适的滤光片控制,从而可限制允许通过的波长。在确定整个光学系统的光谱效果时,要求进行额外的技术校正,需要考虑诸如玻璃的透射率和检测器的灵敏度对应不同波长的差异等因素。
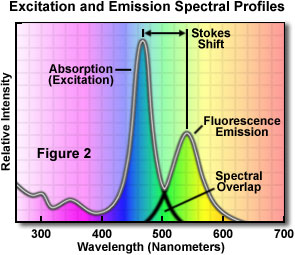
图2显示了一个典型荧光染料的吸收-发射光谱图。请注意,这一典型荧光染料的吸收(常与纯化合物的激发曲线相似)和发射荧光强度曲线在形状上有些相似。此外,在激发曲线的长波长端和发射曲线的短波长端有部分重叠。
激发和发射波长的分离
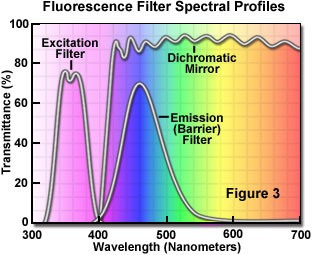
激发和发射波长的分离可通过选择适当的滤光片阻止或放行光谱中的特定波长而实现,如图3所示。荧光照明器的设计是基于对激发光和发射光的控制,即在通向样本的(激发)光路和样本所产生的(发射)光路中插入可随时更换的滤光片。考虑到发射强度低的情况,选择的激发光源必须有足够的亮度,这样才能最大限度地检测到相对较弱的发射光,同时选择的荧光染料需要具备合适的吸收和发射效率。
荧光染料吸收激发光的效率称为分子消光系数。分子消光系数越大,给定波长范围内光吸收的可能性就越大(诱发荧光发射的前提条件之一)。发射光的产率称为量子产率,即发射的量子数(能量“包”)与吸收的量子数之比(许多商用荧光染料的产率在0.1和0.9之间)。量子产率低于1是能量通过非辐射路径(如热或者光化学反应),而不是通过荧光的再辐射路径损失能量的结果。表1中给出了一组特定荧光染料的荧光量子产率。请注意,有些荧光染料的量子产率似乎很低(苯),而其他则很高(荧光素和罗丹明-B)。
荧光染料的荧光量子产率
表1
| 化合物 | 溶剂 | 激发
波长 (nm) | 发射
波长 (nm) | 量子产率 |
|---|---|---|---|---|
| 吖啶橙 | 乙醇 | 493 | 535 | 0.46 |
| 苯 | 乙醇 | 248 | 300-350 | 0.04 |
| 叶绿素A | 乙醇 | 440 | 685 | 0.23 |
| 伊红 | 水 | 521 | 544 | 0.16 |
| 荧光素 | 水 | 437 | 515 | 0.92 |
| 罗丹明-B | 乙醇 | 555 | 627 | 0.97 |
光源的分子消光系数、量子产率和平均发光强度(固有亮度)以及荧光寿命(激发态的持续时间)都是影响荧光发射强度和可用性的重要因素。此外,荧光染料周围的局部环境是决定荧光发射特性的关键因素。环境中的溶剂粘度、离子浓度、pH值和疏水性等变量,对荧光强度和激发态的寿命都有着重要影响。
荧光的分子机理
另一种描绘荧光活性的方法是雅布隆斯基(Jablonski)图,如图4(a)所示。激发前,分子的电子构型通常处于基态下。吸收了激发光的一个光子后,电子可能在短短的几飞秒(10-15秒)内获得更高的能量跃迁到振动激发态。
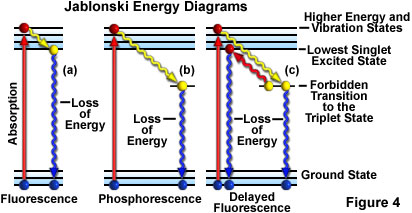
在大约万亿分之一秒(皮秒或10-12秒)内,激发态电子可能会向周围环境中释放部分振动能,并返回到最低激发单重态。随后,电子可从最低激发单重态“弛豫”回到基态,同时发射荧光,如图4(a)所示。发射光的波长始终比激发光波长长(斯托克斯定律),而且只要激发光一直照射荧光标本,发射光就会持续存在。如果激发光停止,发射荧光也会消失。
有时,激发后的电子不会在振动效应下弛豫到最低的单重态,而是向激发三重态进行跃迁,然后再回到基态,在这个过程中,辐射的发射现象可明显延迟几秒或更多时间。这一现象是磷光的特征,如图4(b)所示。在某些情况下,激发后的电子可能会从三重态回到最低的激发单重态,然后再回到基态,随后发射荧光。这一作用的时间比通常的荧光略长(约一两微秒),称为延迟荧光(图4(c))。在光漂白或存在重金属盐或其他化学物质等其他情况下,发射光可明显降低甚至完全消失。
褪色或光漂白
有些特定条件可影响受激发的荧光基团的再辐射,从而导致荧光强度下降。这种降低发射光强度的现象通常称为褪色或光漂白。有时会将褪色进一步细分为淬灭和漂白。漂白是荧光分子在分子氧存在下由于光强而发生的不可逆分解。淬灭也会导致荧光强度降低,且常由氧化剂的作用或存在重金属盐或卤素化合物而导致。
通常,淬灭是由于能量从激发态荧光基团转移到物理上接近的其他受体分子而形成的,也称为共振能量转移。这种特殊的现象已经成为一种更新技术的基础,这种技术用于测量远低于光学显微镜横向分辨率的距离。
漂白的发生导致了FRAP技术的形成,即荧光漂白后恢复技术。FRAP技术利用短脉冲激光漂白,从而可观察随后因荧光基团扩散到漂白区域中而引起的荧光恢复现象。
常用抗淬灭试剂的特性
表2
| 防褪色剂 | 注释 |
|---|---|
| 对苯二胺 | 对FITC最有效试剂。也对罗丹明有效。使用甘油/PBS进行配制,浓度为0.1%。此试剂在光照下会变黑,应存放于暗处。接触皮肤时极其危险。 |
| 三乙烯二胺 (1,4-二氮杂二环-2,2,2-辛烷) | 对FITC高度有效。与对苯二胺相比,效果略低,但其更耐光,且安全水平更高。 |
| 没食子酸正丙酯 | 对罗丹明和FITC都有效果。使用甘油/PBS进行配制,浓度为0.1%。 |
| 2-巯基乙胺 | 用于观察碘化丙啶、吖啶橙或色霉素A3染色的染色体和DNA样本。应在Tris-EDTA中调节至0.1mM 2-巯基乙胺的含量。 |
为了降低部分样本的褪色程度,建议在光到达激发滤光片之前的光路中使用一个中性灰度滤光片,可以降低激发光的强度。在其他情况下,可改变封片剂的pH值或使用抗漂白剂(表2中列出了几种较为重要的试剂)可减轻褪色效应。在数字成像、显微成像或简单目视观察时,快速改变观察视野也可避免褪色效应。
对不起,此内容在您的国家不适用。